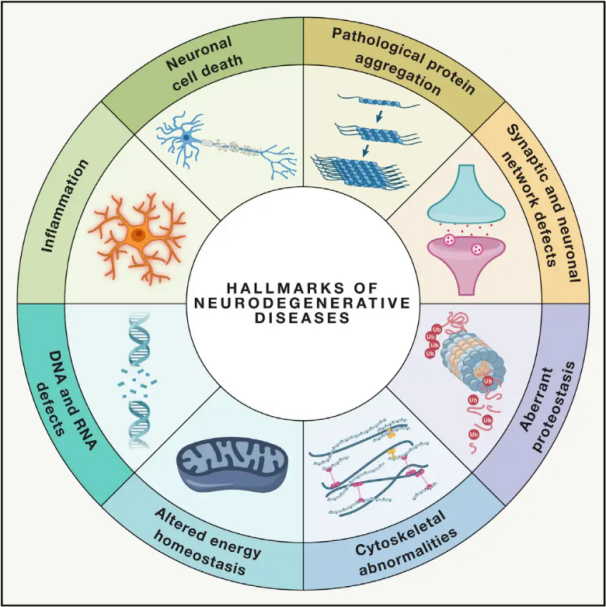
بیماریهای نورودژنراتیو(NDDs) با از دست دادن پیشرونده یا مداوم جمعیتهای عصبی آسیبپذیر خاص در مغز یا نخاع مشخص میشوند. طبقهبندی NDDs میتواند بر اساس معیارهای مختلفی از جمله توزیع آناتومیکی تخریب عصبی (مانند اختلالات خارج هرمی، تخریب پیشانی-گیجگاهی یا آتاکسیهای اسپینوسربلار)، ناهنجاریهای مولکولی اولیه (مانند آمیلوئید-β، پریونها، تائو یا α-سینوکلئین) یا ویژگیهای بالینی اصلی (مانند بیماری پارکینسون، اسکلروز جانبی آمیوتروفیک و زوال عقل) باشد. با وجود این تفاوتها در طبقهبندی و ارائه علائم، اختلالاتی مانند بیماری پارکینسون (PD)، اسکلروز جانبی آمیوتروفیک (ALS) و بیماری آلزایمر (AD) فرآیندهای اساسی مشترکی دارند که منجر به اختلال عملکرد عصبی و در نهایت مرگ سلولی میشوند.
با توجه به اینکه میلیونها نفر در سراسر جهان به بیماریهای غیرواگیر مبتلا هستند، سازمان بهداشت جهانی تخمین میزند که تا سال ۲۰۴۰، این بیماریها به دومین علت اصلی مرگ و میر در کشورهای توسعهیافته تبدیل خواهند شد. در حالی که درمانهای مختلفی برای کاهش و مدیریت علائم مرتبط با بیماریهای خاص وجود دارد، روشهای مؤثر برای کاهش یا درمان پیشرفت این بیماریها همچنان مبهم است. مطالعات اخیر نشان دهنده تغییر در الگوهای درمانی از مدیریت علائم صرف به استفاده از مکانیسمهای محافظت سلولی برای جلوگیری از وخامت بیشتر است. شواهد گسترده نشان میدهد که استرس اکسیداتیو و التهاب نقش محوری در تخریب عصبی دارند و این مکانیسمها را به عنوان اهداف حیاتی برای محافظت سلولی قرار میدهند. در سالهای اخیر، تحقیقات بنیادی و بالینی از پتانسیل درمان با اکسیژن پرفشار (HBOT) در درمان بیماریهای عصبی دژنراتیو پرده برداشته است.
آشنایی با درمان با اکسیژن پرفشار (HBOT)
HBOT معمولاً شامل افزایش فشار به بالاتر از ۱ اتمسفر مطلق (ATA) - فشار در سطح دریا - برای مدت ۹۰ تا ۱۲۰ دقیقه است که اغلب بسته به شرایط خاص تحت درمان، به چندین جلسه نیاز دارد. فشار هوای افزایش یافته، رساندن اکسیژن به سلولها را بهبود میبخشد که به نوبه خود تکثیر سلولهای بنیادی را تحریک کرده و فرآیندهای بهبودی را که توسط فاکتورهای رشد خاصی انجام میشوند، تقویت میکند.
در ابتدا، کاربرد HBOT بر اساس قانون بویل-ماریوت بنا نهاده شد که کاهش وابسته به فشار حبابهای گاز را در کنار مزایای سطوح بالای اکسیژن در بافتها فرض میکند. طیف وسیعی از آسیبشناسیها وجود دارند که از حالت هیپراکسیک تولید شده توسط HBOT بهرهمند میشوند، از جمله بافتهای نکروتیک، آسیبهای ناشی از تشعشع، تروما، سوختگی، سندرم کمپارتمان و گانگرن گازی، و موارد دیگری که توسط انجمن پزشکی زیر دریا و هیپرباریک فهرست شدهاند. نکته قابل توجه این است که HBOT همچنین به عنوان یک درمان کمکی در مدلهای مختلف بیماریهای التهابی یا عفونی، مانند کولیت و سپسیس، اثربخشی خود را نشان داده است. با توجه به مکانیسمهای ضد التهابی و اکسیداتیو آن، HBOT پتانسیل قابل توجهی را به عنوان یک راه درمانی برای بیماریهای نورودژنراتیو ارائه میدهد.
مطالعات پیشبالینی درمان با اکسیژن پرفشار در بیماریهای نورودژنراتیو: بینشهایی از مدل موشی 3×Tg
یکی از مطالعات قابل توجهبر روی مدل موشی 3×Tg بیماری آلزایمر (AD) تمرکز کرد که پتانسیل درمانی HBOT را در بهبود نقصهای شناختی نشان داد. این تحقیق شامل موشهای نر 17 ماهه 3×Tg در مقایسه با موشهای نر 14 ماهه C57BL/6 به عنوان گروه کنترل بود. این مطالعه نشان داد که HBOT نه تنها عملکرد شناختی را بهبود میبخشد، بلکه التهاب، بار پلاک و فسفوریلاسیون Tau - یک فرآیند حیاتی مرتبط با آسیبشناسی آلزایمر - را نیز به طور قابل توجهی کاهش میدهد.
اثرات محافظتی HBOT به کاهش التهاب عصبی نسبت داده شد. این امر با کاهش تکثیر میکروگلیا، آستروگلیوز و ترشح سیتوکینهای پیشالتهابی اثبات شد. این یافتهها بر نقش دوگانه HBOT در افزایش عملکرد شناختی و همزمان کاهش فرآیندهای التهابی عصبی مرتبط با بیماری آلزایمر تأکید دارند.
یک مدل پیشبالینی دیگر از موشهای ۱-متیل-۴-فنیل-۱،۲،۳،۶-تتراهیدروپیریدین (MPTP) برای ارزیابی مکانیسمهای محافظتی HBOT بر عملکرد عصبی و قابلیتهای حرکتی استفاده کرد. نتایج نشان داد که HBOT به افزایش فعالیت حرکتی و قدرت گرفتن در این موشها کمک میکند، که با افزایش سیگنالینگ بیوژنز میتوکندری، به ویژه از طریق فعالسازی SIRT-1، PGC-1α و TFAM، مرتبط است. این موضوع نقش مهم عملکرد میتوکندری را در اثرات محافظت عصبی HBOT برجسته میکند.
مکانیسمهای HBOT در بیماریهای نورودژنراتیو
اصل اساسی استفاده از HBOT برای NDDها در رابطه بین کاهش اکسیژنرسانی و حساسیت به تغییرات نورودژنراتیو نهفته است. فاکتور القا شده توسط هیپوکسی-۱ (HIF-1) نقش محوری به عنوان یک فاکتور رونویسی ایفا میکند که سازگاری سلولی با فشار کم اکسیژن را ممکن میسازد و در NDDهای مختلف از جمله AD، PD، بیماری هانتینگتون و ALS نقش دارد و آن را به یک هدف دارویی حیاتی تبدیل کرده است.
با توجه به اینکه سن یک عامل خطر مهم برای اختلالات عصبی متعدد است، بررسی تأثیر HBOT بر نوروبیولوژی پیری حیاتی است. مطالعات نشان دادهاند که HBOT میتواند نقصهای شناختی مرتبط با سن را در افراد مسن سالم بهبود بخشد.علاوه بر این، بیماران مسن با اختلالات حافظه قابل توجه، پس از قرار گرفتن در معرض HBOT، بهبود شناختی و افزایش جریان خون مغزی را نشان دادند.
۱. تأثیر HBOT بر التهاب و استرس اکسیداتیو
HBOT توانایی کاهش التهاب عصبی را در بیماران مبتلا به اختلال عملکرد شدید مغز نشان داده است. این روش توانایی کاهش سیتوکینهای پیشالتهابی (مانند IL-1β، IL-12، TNFα و IFNγ) و افزایش سیتوکینهای ضدالتهابی (مانند IL-10) را دارد. برخی از محققان پیشنهاد میکنند که گونههای فعال اکسیژن (ROS) تولید شده توسط HBOT واسطه چندین اثر مفید این درمان هستند. در نتیجه، جدا از عملکرد کاهش حباب وابسته به فشار و دستیابی به اشباع اکسیژن بالای بافت، پیامدهای مثبت مرتبط با HBOT تا حدودی به نقشهای فیزیولوژیکی ROS تولید شده بستگی دارد.
۲. اثرات HBOT بر آپوپتوز و محافظت عصبی
تحقیقات نشان داده است که HBOT میتواند فسفوریلاسیون هیپوکامپ پروتئین کیناز فعالشده با میتوژن (MAPK) p38 را کاهش دهد و متعاقباً شناخت را بهبود بخشد و آسیب هیپوکامپ را کاهش دهد. مشخص شده است که HBOT به تنهایی و در ترکیب با عصاره جینکو بیلوبا، بیان Bax و فعالیت کاسپاز-9/3 را کاهش میدهند و در نتیجه میزان آپوپتوز را در مدلهای جوندگان القا شده توسط aβ25-35 کاهش میدهند. علاوه بر این، مطالعه دیگری نشان داد که پیششرطیسازی HBOT با مکانیسمهایی شامل افزایش بیان SIRT1، در کنار افزایش سطح لنفوم سلول B 2 (Bcl-2) و کاهش کاسپاز-3 فعال، تحمل در برابر ایسکمی مغزی را القا میکند که بر خواص محافظت عصبی و ضد آپوپتوز HBOT تأکید دارد.
۳. تأثیر HBOT بر گردش خون ونوروژنز
قرار دادن افراد در معرض HBOT با اثرات متعددی بر سیستم عروقی جمجمه، از جمله افزایش نفوذپذیری سد خونی-مغزی، تقویت رگزایی و کاهش ادم، مرتبط بوده است. HBOT علاوه بر فراهم کردن اکسیژن بیشتر برای بافتها،تشکیل عروق را تقویت میکندبا فعال کردن فاکتورهای رونویسی مانند فاکتور رشد اندوتلیال عروقی و با تحریک تکثیر سلولهای بنیادی عصبی.
۴. اثرات اپیژنتیکی HBOT
مطالعات نشان دادهاند که قرار گرفتن سلولهای اندوتلیال ریزرگی انسان (HMEC-1) در معرض اکسیژن پرفشار، به طور قابل توجهی ۸۱۰۱ ژن، از جمله بیان افزایش یافته و کاهش یافته را تنظیم میکند و افزایش بیان ژن مرتبط با مسیرهای پاسخ آنتیاکسیدانی را برجسته میکند.
نتیجهگیری
استفاده از HBOT در طول زمان پیشرفتهای چشمگیری داشته و در دسترس بودن، قابلیت اطمینان و ایمنی آن را در عمل بالینی اثبات کرده است. در حالی که HBOT به عنوان یک درمان بدون تایید برای NDDs مورد بررسی قرار گرفته و برخی تحقیقات انجام شده است، اما همچنان نیاز مبرمی به مطالعات دقیق برای استانداردسازی شیوههای HBOT در درمان این بیماریها وجود دارد. تحقیقات بیشتر برای تعیین فرکانسهای بهینه درمان و ارزیابی میزان اثرات مفید برای بیماران ضروری است.
به طور خلاصه، تلاقی اکسیژن پرفشار و بیماریهای نورودژنراتیو، مرز امیدبخشی را در امکانات درمانی نشان میدهد که مستلزم کاوش و اعتبارسنجی مداوم در محیطهای بالینی است.
زمان ارسال: ۱۶ مه ۲۰۲۵

