در حوزه پزشکی مدرن، آنتیبیوتیکها به عنوان یکی از مهمترین پیشرفتها شناخته شدهاند و به طور چشمگیری میزان بروز و مرگ و میر مرتبط با عفونتهای میکروبی را کاهش دادهاند. توانایی آنها در تغییر نتایج بالینی عفونتهای باکتریایی، امید به زندگی بیماران بیشماری را افزایش داده است. آنتیبیوتیکها در روشهای پیچیده پزشکی، از جمله جراحیها، کاشت ایمپلنت، پیوند اعضا و شیمیدرمانی، بسیار مهم هستند. با این حال، ظهور پاتوژنهای مقاوم به آنتیبیوتیک نگرانی فزایندهای بوده است که به مرور زمان اثربخشی این داروها را کاهش میدهد. مواردی از مقاومت آنتیبیوتیکی در تمام دستههای آنتیبیوتیکها با وقوع جهشهای میکروبی ثبت شده است. فشار انتخابی اعمال شده توسط داروهای ضد میکروبی به افزایش سویههای مقاوم کمک کرده و چالش مهمی را برای سلامت جهانی ایجاد کرده است.
برای مقابله با مسئلهی مهم مقاومت ضدمیکروبی، اجرای سیاستهای مؤثر کنترل عفونت که گسترش عوامل بیماریزای مقاوم را محدود میکند، در کنار کاهش استفاده از آنتیبیوتیکها، ضروری است. علاوه بر این، نیاز مبرمی به روشهای درمانی جایگزین وجود دارد. درمان با اکسیژن پرفشار (HBOT) به عنوان یک روش امیدوارکننده در این زمینه ظهور کرده است که شامل استنشاق اکسیژن ۱۰۰٪ در سطوح فشار خاص برای یک دوره زمانی است. HBOT که به عنوان یک درمان اولیه یا مکمل برای عفونتها قرار میگیرد، ممکن است امید جدیدی در درمان عفونتهای حاد ناشی از عوامل بیماریزای مقاوم به آنتیبیوتیک ارائه دهد.
این روش درمانی به طور فزایندهای به عنوان درمان اصلی یا جایگزین برای بیماریهای مختلف، از جمله التهاب، مسمومیت با مونوکسید کربن، زخمهای مزمن، بیماریهای ایسکمیک و عفونتها، مورد استفاده قرار میگیرد. کاربردهای بالینی HBOT در درمان عفونت بسیار گسترده است و مزایای ارزشمندی را برای بیماران فراهم میکند.

کاربردهای بالینی درمان با اکسیژن پرفشار در عفونت
شواهد موجود به طور قاطع از کاربرد HBOT، چه به عنوان یک درمان مستقل و چه به عنوان درمان کمکی، حمایت میکنند و مزایای قابل توجهی را برای بیماران مبتلا به عفونت ارائه میدهند. در طول HBOT، فشار اکسیژن خون شریانی میتواند تا 2000 میلیمتر جیوه افزایش یابد و گرادیان فشار بالای اکسیژن-بافت حاصل میتواند سطح اکسیژن بافت را تا 500 میلیمتر جیوه افزایش دهد. چنین اثراتی به ویژه در بهبود پاسخهای التهابی و اختلالات ریزگردش خون مشاهده شده در محیطهای ایسکمیک و همچنین در مدیریت سندرم کمپارتمان ارزشمند هستند.
HBOT همچنین میتواند بر بیماریهایی که به سیستم ایمنی وابسته هستند تأثیر بگذارد. تحقیقات نشان میدهد که HBOT میتواند سندرمهای خودایمنی و پاسخهای ایمنی ناشی از آنتیژن را سرکوب کند و با کاهش گردش لنفوسیتها و لکوسیتها و در عین حال تعدیل پاسخهای ایمنی، به حفظ تحمل پیوند کمک کند. علاوه بر این، HBOTاز بهبودی پشتیبانی میکنددر ضایعات مزمن پوستی با تحریک رگزایی، که یک فرآیند حیاتی برای بهبود بهبودی است. این درمان همچنین تشکیل ماتریکس کلاژن، یک مرحله ضروری در بهبود زخم، را تشویق میکند.
باید توجه ویژهای به عفونتهای خاص، به ویژه عفونتهای عمیق و صعبالعلاج مانند فاشئیت نکروزان، استئومیلیت، عفونتهای مزمن بافت نرم و اندوکاردیت عفونی، شود. یکی از رایجترین کاربردهای بالینی HBOT برای عفونتهای بافت نرم پوست و استئومیلیت مرتبط با سطوح پایین اکسیژن است که اغلب توسط باکتریهای بیهوازی یا مقاوم ایجاد میشوند.
۱. عفونتهای پای دیابتی
پای دیابتیزخمها یک عارضه شایع در بین بیماران دیابتی هستند که تا 25٪ از این جمعیت را تحت تأثیر قرار میدهند. عفونتها اغلب در این زخمها ایجاد میشوند (40٪ تا 80٪ موارد را تشکیل میدهند) و منجر به افزایش عوارض و مرگ و میر میشوند. عفونتهای پای دیابتی (DFI) معمولاً شامل عفونتهای چند میکروبی با انواع پاتوژنهای باکتریایی بیهوازی شناسایی شده هستند. عوامل مختلفی، از جمله نقص عملکرد فیبروبلاست، مشکلات تشکیل کلاژن، مکانیسمهای ایمنی سلولی و عملکرد فاگوسیتها، میتوانند مانع بهبود زخم در بیماران دیابتی شوند. مطالعات متعددی، اختلال در اکسیژنرسانی پوست را به عنوان یک عامل خطر قوی برای قطع عضو مرتبط با DFIها شناسایی کردهاند.
به عنوان یکی از گزینههای فعلی برای درمان عفونت پای دیابتی (DFI)گزارش شده است که HBOT میزان بهبودی زخمهای پای دیابتی را به طور قابل توجهی افزایش میدهد و متعاقباً نیاز به قطع عضو و مداخلات جراحی پیچیده را کاهش میدهد. این روش نه تنها نیاز به روشهای پرهزینه مانند جراحی فلپ و پیوند پوست را به حداقل میرساند، بلکه در مقایسه با گزینههای جراحی، هزینهها و عوارض جانبی کمتری نیز دارد. مطالعهای توسط چن و همکارانش نشان داد که بیش از 10 جلسه HBOT منجر به بهبود 78.3 درصدی در میزان بهبودی زخم در بیماران دیابتی شده است.
۲. عفونتهای نکروزان بافت نرم
عفونتهای نکروزان بافت نرم (NSTIs) اغلب چندمیکروبی هستند و معمولاً از ترکیبی از پاتوژنهای باکتریایی هوازی و بیهوازی ناشی میشوند و اغلب با تولید گاز همراه هستند. اگرچه NSTIs نسبتاً نادر هستند، اما به دلیل پیشرفت سریع، میزان مرگ و میر بالایی دارند. تشخیص و درمان به موقع و مناسب، کلید دستیابی به نتایج مطلوب است و HBOT به عنوان یک روش کمکی برای مدیریت NSTIs توصیه شده است. اگرچه به دلیل فقدان مطالعات کنترلشده آیندهنگر، هنوز در مورد استفاده از HBOT در NSTIs اختلاف نظر وجود دارد،شواهد نشان میدهد که ممکن است با بهبود میزان بقا و حفظ اندام در بیماران NSTI مرتبط باشد.یک مطالعه گذشتهنگر نشان داد که کاهش قابل توجهی در میزان مرگ و میر در بین بیماران NSTI که HBOT دریافت میکنند، وجود دارد.
۱.۳ عفونت محل جراحی
عفونتهای محل جراحی (SSI) را میتوان بر اساس محل آناتومیک عفونت طبقهبندی کرد و میتوانند از عوامل بیماریزای مختلفی از جمله باکتریهای هوازی و بیهوازی ناشی شوند. علیرغم پیشرفت در اقدامات کنترل عفونت، مانند تکنیکهای استریلیزاسیون، استفاده از آنتیبیوتیکهای پیشگیرانه و پیشرفت در روشهای جراحی، عفونتهای محل جراحی همچنان یک عارضه مداوم هستند.
یک بررسی مهم، اثربخشی HBOT را در پیشگیری از عفونتهای محل جراحی عمیق در جراحی اسکولیوز عصبی-عضلانی بررسی کرده است. HBOT قبل از عمل ممکن است به طور قابل توجهی میزان بروز عفونتهای محل جراحی را کاهش داده و بهبود زخم را تسهیل کند. این درمان غیرتهاجمی محیطی را ایجاد میکند که در آن سطح اکسیژن در بافتهای زخم بالا میرود، که با عمل از بین بردن اکسیداتیو عوامل بیماریزا مرتبط است. علاوه بر این، به کاهش سطح خون و اکسیژن که در ایجاد عفونتهای محل جراحی نقش دارند، میپردازد. فراتر از سایر استراتژیهای کنترل عفونت، HBOT به ویژه برای جراحیهای تمیز و آلوده مانند جراحیهای کولورکتال توصیه شده است.
۱.۴ سوختگی
سوختگیها آسیبهایی هستند که در اثر گرمای شدید، جریان الکتریکی، مواد شیمیایی یا تابش ایجاد میشوند و میتوانند میزان مرگ و میر بالایی داشته باشند. HBOT با افزایش سطح اکسیژن در بافتهای آسیبدیده در درمان سوختگی مفید است. در حالی که مطالعات حیوانی و بالینی نتایج متفاوتی در مورد ...اثربخشی HBOT در درمان سوختگییک مطالعه شامل ۱۲۵ بیمار سوختگی نشان داد که HBOT هیچ تأثیر قابل توجهی بر میزان مرگ و میر یا تعداد جراحیهای انجام شده نشان نداد، اما میانگین زمان بهبودی را کاهش داد (۱۹.۷ روز در مقایسه با ۴۳.۸ روز). ادغام HBOT با مدیریت جامع سوختگی میتواند به طور مؤثر سپسیس را در بیماران سوختگی کنترل کند و منجر به کوتاهتر شدن زمان بهبودی و کاهش نیاز به مایعات شود. با این حال، تحقیقات آیندهنگر گستردهتری برای تأیید نقش HBOT در مدیریت سوختگیهای گسترده مورد نیاز است.
۱.۵ استئومیلیت
استئومیلیت عفونت استخوان یا مغز استخوان است که اغلب توسط عوامل بیماریزای باکتریایی ایجاد میشود. درمان استئومیلیت به دلیل خونرسانی نسبتاً ضعیف به استخوانها و نفوذ محدود آنتیبیوتیکها به مغز استخوان میتواند چالشبرانگیز باشد. استئومیلیت مزمن با عوامل بیماریزای پایدار، التهاب خفیف و تشکیل بافت استخوانی نکروتیک مشخص میشود. استئومیلیت مقاوم به درمان به عفونتهای مزمن استخوانی اشاره دارد که علیرغم درمان مناسب ادامه مییابند یا عود میکنند.
نشان داده شده است که HBOT به طور قابل توجهی سطح اکسیژن را در بافتهای استخوانی آلوده بهبود میبخشد. مطالعات موردی و گروهی متعددی نشان میدهند که HBOT نتایج بالینی را برای بیماران مبتلا به استئومیلیت بهبود میبخشد. به نظر میرسد که از طریق مکانیسمهای مختلفی از جمله افزایش فعالیت متابولیک، سرکوب پاتوژنهای باکتریایی، افزایش اثرات آنتیبیوتیک، به حداقل رساندن التهاب و بهبود زخم عمل میکند.پس از HBOT، ۶۰ تا ۸۵ درصد از بیماران مبتلا به استئومیلیت مزمن و مقاوم به درمان، علائم سرکوب عفونت را نشان میدهند.
۱.۶ عفونتهای قارچی
در سطح جهان، بیش از سه میلیون نفر از عفونتهای قارچی مزمن یا تهاجمی رنج میبرند که سالانه منجر به بیش از ۶۰۰۰۰۰ مرگ میشود. نتایج درمان عفونتهای قارچی اغلب به دلیل عواملی مانند تغییر وضعیت ایمنی، بیماریهای زمینهای و ویژگیهای بیماریزایی پاتوژن به خطر میافتد. HBOT به دلیل ایمنی و ماهیت غیرتهاجمی خود، به یک گزینه درمانی جذاب در عفونتهای قارچی شدید تبدیل میشود. مطالعات نشان میدهد که HBOT میتواند در برابر پاتوژنهای قارچی مانند آسپرژیلوس و مایکوباکتریوم توبرکلوزیس مؤثر باشد.
HBOT با مهار تشکیل بیوفیلم آسپرژیلوس، اثرات ضد قارچی را تقویت میکند و افزایش کارایی آن در سویههای فاقد ژنهای سوپراکسید دیسموتاز (SOD) مشاهده شده است. شرایط هیپوکسیک در طول عفونتهای قارچی، چالشهایی را برای رساندن داروی ضد قارچی ایجاد میکند و افزایش سطح اکسیژن حاصل از HBOT را به یک مداخله بالقوه مفید تبدیل میکند، اگرچه تحقیقات بیشتر ضروری است.
خواص ضد میکروبی HBOT
محیط هیپراکسیک ایجاد شده توسط HBOT، تغییرات فیزیولوژیکی و بیوشیمیایی را آغاز میکند که خواص ضد باکتریایی را تحریک میکند و آن را به یک درمان کمکی مؤثر برای عفونت تبدیل میکند. HBOT از طریق مکانیسمهایی مانند فعالیت باکتریکشی مستقیم، تقویت پاسخهای ایمنی و اثرات همافزایی با عوامل ضد میکروبی خاص، اثرات قابل توجهی را در برابر باکتریهای هوازی و عمدتاً باکتریهای بیهوازی نشان میدهد.
۲.۱ اثرات ضد باکتریایی مستقیم HBOT
اثر ضد باکتریایی مستقیم HBOT تا حد زیادی به تولید گونههای فعال اکسیژن (ROS) نسبت داده میشود که شامل آنیونهای سوپراکسید، پراکسید هیدروژن، رادیکالهای هیدروکسیل و یونهای هیدروکسیل هستند که همگی در طول متابولیسم سلولی ایجاد میشوند.
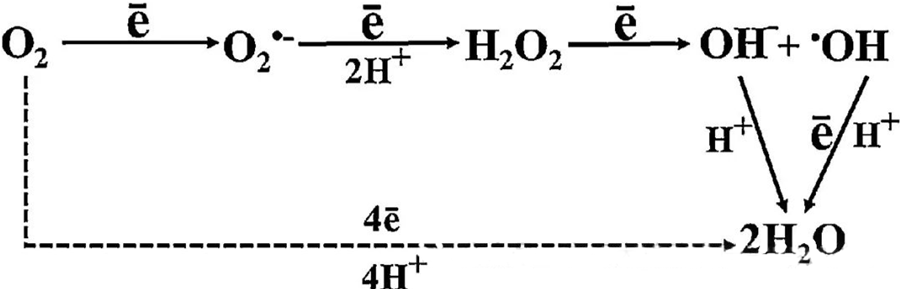
برهمکنش بین O₂ و اجزای سلولی برای درک چگونگی تشکیل ROS در سلولها ضروری است. تحت شرایط خاصی که به عنوان استرس اکسیداتیو شناخته میشود، تعادل بین تشکیل ROS و تخریب آن مختل میشود و منجر به افزایش سطح ROS در سلولها میشود. تولید سوپراکسید (O₂⁻) توسط سوپراکسید دیسموتاز کاتالیز میشود که متعاقباً O₂⁻ را به پراکسید هیدروژن (H₂O₂) تبدیل میکند. این تبدیل توسط واکنش فنتون که Fe²⁺ را اکسید میکند تا رادیکالهای هیدروکسیل (·OH) و Fe³⁺ تولید کند، بیشتر تقویت میشود و بنابراین یک توالی ردوکس مضر از تشکیل ROS و آسیب سلولی را آغاز میکند.
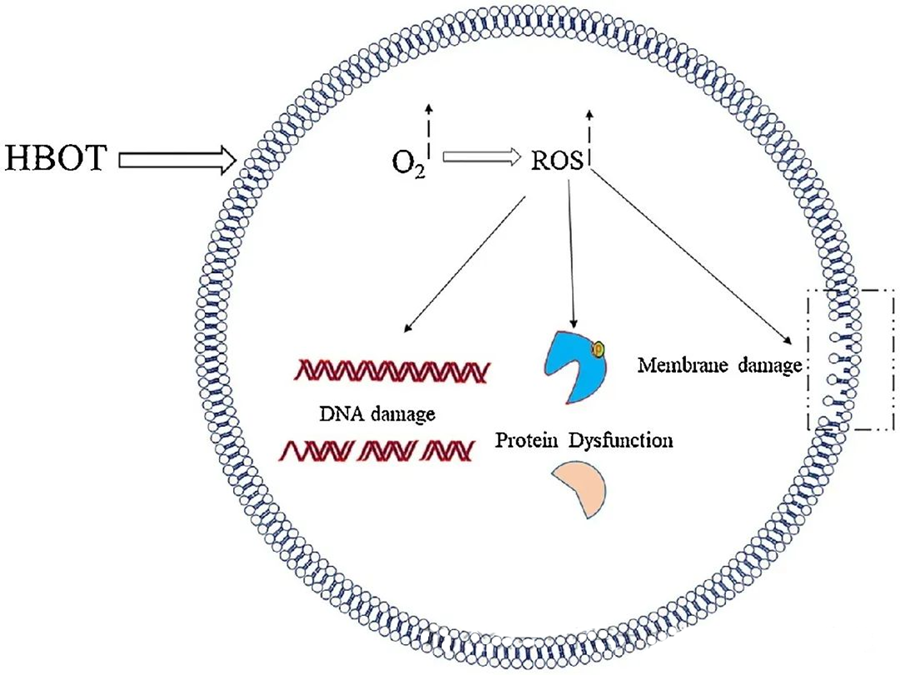
اثرات سمی ROS اجزای حیاتی سلولی مانند DNA، RNA، پروتئینها و لیپیدها را هدف قرار میدهد. نکته قابل توجه این است که DNA هدف اصلی سمیت سلولی ناشی از H₂O₂ است، زیرا ساختارهای دئوکسی ریبوز را مختل کرده و به ترکیبات پایه آسیب میرساند. آسیب فیزیکی ناشی از ROS به ساختار مارپیچ DNA نیز گسترش مییابد که به طور بالقوه ناشی از پراکسیداسیون لیپیدی ناشی از ROS است. این امر پیامدهای نامطلوب افزایش سطح ROS در سیستمهای بیولوژیکی را برجسته میکند.
اثر ضد میکروبی گونههای فعال اکسیژن (ROS)
همانطور که از طریق تولید ROS ناشی از HBOT نشان داده شده است، ROS نقش حیاتی در مهار رشد میکروبی دارد. اثرات سمی ROS مستقیماً اجزای سلولی مانند DNA، پروتئینها و لیپیدها را هدف قرار میدهد. غلظت بالای گونههای فعال اکسیژن میتواند مستقیماً به لیپیدها آسیب برساند و منجر به پراکسیداسیون لیپید شود. این فرآیند، یکپارچگی غشاهای سلولی و در نتیجه، عملکرد گیرندهها و پروتئینهای مرتبط با غشا را به خطر میاندازد.
علاوه بر این، پروتئینها، که اهداف مولکولی مهمی برای ROS نیز هستند، تحت تغییرات اکسیداتیو خاصی در باقیماندههای اسید آمینه مختلف مانند سیستئین، متیونین، تیروزین، فنیلآلانین و تریپتوفان قرار میگیرند. به عنوان مثال، نشان داده شده است که HBOT باعث ایجاد تغییرات اکسیداتیو در چندین پروتئین در E. coli، از جمله فاکتور طویلسازی G و DnaK میشود و در نتیجه بر عملکرد سلولی آنها تأثیر میگذارد.
تقویت سیستم ایمنی از طریق HBOT
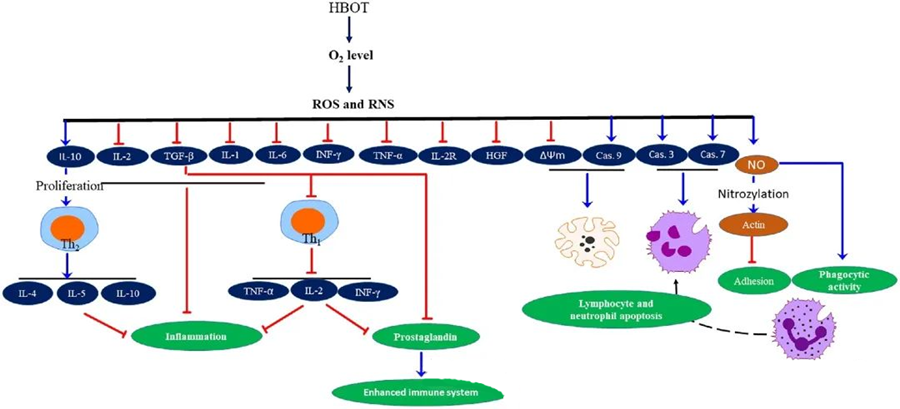
خواص ضد التهابی HBOTمستند شدهاند و ثابت کردهاند که برای کاهش آسیب بافتی و سرکوب پیشرفت عفونت بسیار مهم هستند. HBOT به طور قابل توجهی بر بیان سیتوکینها و سایر تنظیمکنندههای التهابی تأثیر میگذارد و بر پاسخ ایمنی تأثیر میگذارد. سیستمهای تجربی مختلف، تغییرات متفاوتی را در بیان ژن و تولید پروتئین پس از HBOT مشاهده کردند که یا باعث افزایش یا کاهش بیان فاکتورهای رشد و سیتوکینها میشود.
در طول فرآیند HBOT، افزایش سطح O₂ طیف وسیعی از پاسخهای سلولی، مانند سرکوب آزادسازی واسطههای پیشالتهابی و ترویج آپوپتوز لنفوسیتها و نوتروفیلها را تحریک میکند. در مجموع، این اقدامات مکانیسمهای ضد میکروبی سیستم ایمنی را تقویت میکنند و در نتیجه بهبود عفونتها را تسهیل میکنند.
علاوه بر این، مطالعات نشان میدهند که افزایش سطح O₂ در طول HBOT میتواند بیان سیتوکینهای پیشالتهابی، از جمله اینترفرون گاما (IFN-γ)، اینترلوکین-1 (IL-1) و اینترلوکین-6 (IL-6) را کاهش دهد. این تغییرات همچنین شامل کاهش نسبت سلولهای T CD4:CD8 و تعدیل سایر گیرندههای محلول است که در نهایت سطح اینترلوکین-10 (IL-10) را افزایش میدهد، که برای مقابله با التهاب و تقویت بهبود بسیار مهم است.
فعالیتهای ضدمیکروبی HBOT با مکانیسمهای بیولوژیکی پیچیدهای در هم تنیده شدهاند. گزارش شده است که هم سوپراکسید و هم فشار بالا، فعالیت ضدباکتریایی ناشی از HBOT و آپوپتوز نوتروفیلها را به طور متناقضی افزایش میدهند. پس از HBOT، افزایش قابل توجه سطح اکسیژن، تواناییهای باکتریکشی نوتروفیلها، که یک جزء ضروری از پاسخ ایمنی است، را افزایش میدهد. علاوه بر این، HBOT چسبندگی نوتروفیلها را سرکوب میکند، که این امر با تعامل β-اینتگرینهای روی نوتروفیلها با مولکولهای چسبندگی بین سلولی (ICAM) روی سلولهای اندوتلیال انجام میشود. HBOT فعالیت اینتگرین β-2 نوتروفیل (Mac-1، CD11b/CD18) را از طریق فرآیندی با واسطه اکسید نیتریک (NO) مهار میکند و به مهاجرت نوتروفیلها به محل عفونت کمک میکند.
بازآرایی دقیق اسکلت سلولی برای نوتروفیلها جهت فاگوسیته کردن مؤثر عوامل بیماریزا ضروری است. نشان داده شده است که S-نیتروزیلاسیون اکتین، پلیمریزاسیون اکتین را تحریک میکند و به طور بالقوه فعالیت فاگوسیتیک نوتروفیلها را پس از پیشدرمان با HBOT تسهیل میکند. علاوه بر این، HBOT از طریق مسیرهای میتوکندریایی، آپوپتوز را در ردههای سلولی T انسان افزایش میدهد و گزارش شده است که مرگ لنفوسیتها پس از HBOT تسریع میشود. مسدود کردن کاسپاز-9 - بدون تأثیر بر کاسپاز-8 - اثرات تعدیلکننده سیستم ایمنی HBOT را نشان داده است.
اثرات همافزایی HBOT با عوامل ضدمیکروبی
در کاربردهای بالینی، HBOT اغلب در کنار آنتیبیوتیکها برای مبارزه مؤثر با عفونتها استفاده میشود. حالت هیپراکسیک حاصل از HBOT میتواند بر اثربخشی برخی از عوامل آنتیبیوتیکی تأثیر بگذارد. تحقیقات نشان میدهد که داروهای باکتریکش خاص، مانند بتا-لاکتامها، فلوروکینولونها و آمینوگلیکوزیدها، نه تنها از طریق مکانیسمهای ذاتی عمل میکنند، بلکه تا حدی به متابولیسم هوازی باکتریها نیز متکی هستند. بنابراین، حضور اکسیژن و ویژگیهای متابولیکی عوامل بیماریزا هنگام ارزیابی اثرات درمانی آنتیبیوتیکها بسیار مهم هستند.
شواهد قابل توجهی نشان داده است که سطح پایین اکسیژن میتواند مقاومت سودوموناس آئروژینوزا را در برابر پیپراسیلین/تازوباکتام افزایش دهد و محیط کم اکسیژن نیز در افزایش مقاومت انتروباکتر کلوآکه در برابر آزیترومایسین نقش دارد. برعکس، برخی شرایط هیپوکسی ممکن است حساسیت باکتریها را به آنتیبیوتیکهای تتراسایکلین افزایش دهد. HBOT با القای متابولیسم هوازی و اکسیژنرسانی مجدد به بافتهای آلوده هیپوکسیک، به عنوان یک روش درمانی کمکی مناسب عمل میکند و متعاقباً حساسیت پاتوژنها را به آنتیبیوتیکها افزایش میدهد.
در مطالعات پیشبالینی، ترکیب HBOT - که دو بار در روز به مدت ۸ ساعت در فشار ۲۸۰ کیلوپاسکال تجویز میشد - در کنار توبرامایسین (۲۰ میلیگرم بر کیلوگرم در روز) به طور قابل توجهی بار باکتریایی را در اندوکاردیت عفونی استافیلوکوکوس اورئوس کاهش داد. این نشان دهنده پتانسیل HBOT به عنوان یک درمان کمکی است. تحقیقات بیشتر نشان داده است که تحت دمای ۳۷ درجه سانتیگراد و فشار ۳ اتمسفر به مدت ۵ ساعت، HBOT به طور قابل توجهی اثرات ایمی پنم را در برابر سودوموناس آئروژینوزا آلوده به ماکروفاژ افزایش میدهد. علاوه بر این، روش ترکیبی HBOT با سفازولین در درمان استئومیلیت استافیلوکوکوس اورئوس در مدلهای حیوانی در مقایسه با سفازولین به تنهایی مؤثرتر بوده است.
HBOT همچنین به طور قابل توجهی اثر باکتریکشی سیپروفلوکساسین را در برابر بیوفیلمهای سودوموناس آئروژینوزا، به ویژه پس از ۹۰ دقیقه قرار گرفتن در معرض آن، افزایش میدهد. این افزایش به تشکیل گونههای فعال اکسیژن درونزا (ROS) نسبت داده میشود و حساسیت بیشتری را در جهشیافتههای دارای نقص پراکسیداز نشان میدهد.
در مدلهای التهاب پلور ناشی از استافیلوکوکوس اورئوس مقاوم به متیسیلین (MRSA)، اثر مشترک ونکومایسین، تیکوپلانین و لینزولید با HBOT، افزایش قابل توجهی در اثربخشی علیه MRSA نشان داد. مترونیدازول، آنتیبیوتیکی که به طور گسترده در درمان عفونتهای شدید بیهوازی و چندمیکروبی مانند عفونتهای پای دیابتی (DFI) و عفونتهای محل جراحی (SSI) استفاده میشود، در شرایط بیهوازی اثربخشی ضدمیکروبی بالاتری نشان داده است. مطالعات آینده برای بررسی اثرات ضدباکتریایی همافزایی HBOT همراه با مترونیدازول در هر دو محیط درونتنی (in vivo) و برونتنی (in vitro) ضروری است.
اثربخشی ضد میکروبی HBOT بر باکتریهای مقاوم
با تکامل و گسترش سویههای مقاوم، آنتیبیوتیکهای سنتی اغلب قدرت خود را با گذشت زمان از دست میدهند. علاوه بر این، HBOT ممکن است در درمان و پیشگیری از عفونتهای ناشی از پاتوژنهای مقاوم به چند دارو ضروری باشد و به عنوان یک استراتژی حیاتی در مواقعی که درمانهای آنتیبیوتیکی شکست میخورند، عمل کند. مطالعات متعددی اثرات باکتریکشی قابل توجه HBOT را بر روی باکتریهای مقاوم بالینی گزارش کردهاند. به عنوان مثال، یک جلسه 90 دقیقهای HBOT در 2 ATM به طور قابل توجهی رشد MRSA را کاهش داد. علاوه بر این، در مدلهای نسبت، HBOT اثرات ضد باکتریایی آنتیبیوتیکهای مختلف را در برابر عفونتهای MRSA افزایش داده است. گزارشها تأیید کردهاند که HBOT در درمان استئومیلیت ناشی از کلبسیلا پنومونیه تولیدکننده OXA-48 بدون نیاز به هیچ آنتیبیوتیک کمکی مؤثر است.
به طور خلاصه، درمان با اکسیژن پرفشار، رویکردی چندوجهی برای کنترل عفونت ارائه میدهد که ضمن تقویت پاسخ ایمنی، اثربخشی عوامل ضدمیکروبی موجود را نیز افزایش میدهد. با تحقیق و توسعه جامع، این روش پتانسیل کاهش اثرات مقاومت آنتیبیوتیکی را دارد و در مبارزه مداوم علیه عفونتهای باکتریایی، امیدبخش است.
زمان ارسال: ۲۸ فوریه ۲۰۲۵

